El antígeno-1 secretado por Babesia ovis es un marcador diagnóstico
 El antígeno-1 secretado por Babesia ovis es un marcador diagnóstico durante las infecciones activas por Babesia ovis en ovejas
El antígeno-1 secretado por Babesia ovis es un marcador diagnóstico durante las infecciones activas por Babesia ovis en ovejas
 Ferda Sevinc1*†
Ferda Sevinc1*†  Mo Zhou2†
Mo Zhou2†  Shinuo Cao3*
Shinuo Cao3*  Onu Celan1
Onu Celan1  Mehmet Can Ulucesme4
Mehmet Can Ulucesme4  Sezayi Ozubek4
Sezayi Ozubek4  Munir Aktas4
Munir Aktas4  Xuenan Xuan5
Xuenan Xuan5- 1Departamento de Parasitología, Facultad de Medicina Veterinaria, Universidad de Selcuk, Konya, Türkiye
- 2Laboratorio clave de Jiangsu para la investigación y el desarrollo de alta tecnología de productos biofarmacéuticos veterinarios, Jiangsu Agri-animal Husbandry Vocational College, Taizhou, China
- 3Centro de Investigación de Tecnología de Ingeniería para la Ciencia Animal Moderna y el Nuevo Desarrollo Farmacéutico Veterinario, Jiangsu Agri-animal Husbandry Vocational College, Taizhou, China
- 4Departamento de Parasitología, Facultad de Medicina Veterinaria, Universidad de Firat, Elazig, Türkiye
- 5Centro Nacional de Investigación de Enfermedades Protozoarias, Universidad de Agricultura y Medicina Veterinaria de Obihiro, Obihiro, Japón
La babesiosis ovina causada por Babesia ovis es una enfermedad económicamente significativa. Recientemente, se han identificado algunas proteínas específicas de B. ovis, incluido el antígeno-1 secretado por B. ovis recombinante (rBoSA1). Los análisis inmunológicos revelaron que rBoSA1 reside dentro del citoplasma de los eritrocitos infectados y exhibe propiedades antigénicas robustas para detectar anticuerpos anti-B. ovis. Esta proteína se libera en el torrente sanguíneo durante el desarrollo del parásito. Sería posible diagnosticar infecciones activas mediante la detección de esta proteína secretora. Para este propósito, se optimizó un ELISA sándwich basado en anticuerpos policlonales específicos de rBoSA1 en este estudio. Las muestras de sangre tomadas de ovejas infectadas naturalmente (n: 100) y experimentalmente (n: 15) se analizaron para detectar la presencia de BoSA1 nativa. Los resultados mostraron que el BoSA1 nativo era detectable en el 98% de los animales infectados naturalmente. Hubo una correlación positiva entre el nivel de parasitemia en microscopía y la densidad de proteínas en el ELISA sándwich. Los animales infectados experimentalmente mostraron reacciones positivas desde el primer o segundo día de inoculaciones. Sin embargo, las infecciones experimentales llevadas a cabo por las garrapatas Rhipicephalus bursa revelaron que el BoSA1 nativo era detectable a partir de los 7ésimo Día de fijación de garrapatas cuando el parásito comenzó a verse microscópicamente. Sandwich ELISA fue lo suficientemente sensible como para detectar la proteína rBoSA1 a una concentración de 1,52 ng/ml. Además, no se observó reactividad cruzada serológica entre animales infectados con varias especies de piroplasma, incluyendo Babesia bovis, B. bigemina, B. caballi, B. canis, B. gibsoni, Theileria equi y T. annulata. Tomados en conjunto, los hallazgos muestran que el ELISA sándwich basado en anticuerpos policlonales específicos de rBoSA1 se puede usar con éxito para diagnosticar infecciones clínicas por B. ovis en ovejas en la etapa temprana.
Introducción
Las garrapatas juegan un papel importante en la medicina humana y veterinaria debido a su capacidad para transmitir muchas enfermedades protozoarias, rickettsiales y virales. En particular, proteger a los pequeños rumiantes contra las infestaciones de garrapatas en el campo es demasiado difícil debido a su comportamiento de pastoreo durante largos períodos del año. La babesiosis ovina es una de las enfermedades protozoarias transmitidas por garrapatas más importantes del ganado. Se han observado varios casos epidémicos y endémicos causados por babesiosis ovina en Europa, Oriente Medio, África del Norte y algunos países asiáticos (Yeruham et al., 1998; Fakhar y otros, 2012; Ranjbar-Bahadori et al., 2012; Sevinc et al., 2013; Sevinc et al., 2018; Ceylan y otros, 2021a; Ceylan y otros, 2021b; Stevanovic et al., 2022).
Varias especies de Babesia, a saber, B. ovis, B. motasi, B. crassa, B. foliate y B. taylori han sido identificadas en pequeños rumiantes, y causan babesiosis ovina. Recientemente, se ha prestado gran atención a dos nuevas especies de Babesia en pequeños rumiantes, Babesia sp. Xinjiang en China (Yin et al., 1997; Bai y otros, 2002) y Babesia aktasi n. sp. en Türkiye (Ozubek et al., 2023; Ulucesme et al., 2023), que presentaron morfologías distintas de otras especies ovinas de Babesia en frotis de sangre fina. Dentro de estas especies, B. ovis es responsable de infecciones clínicas y tiene una distribución más amplia que otras especies (Uilenberg, 2006; Guan y otros, 2009; Iqbal y otros, 2011; Ozubek y Aktas, 2017; Ceylan et al., 2021b).
Los síntomas clínicos más prominentes de las infecciones por B. ovis incluyen fiebre, anemia hemolítica y hemoglobinuria. Además de estos síntomas clínicos; La fatiga, la pérdida de apetito, la pérdida de peso y los abortos también pueden ocurrir en casos clínicos. Durante la fase aguda de la infección, los merozoítos de B. ovis proliferan y se desarrollan rápidamente en los eritrocitos. Luego, descomponen estos eritrocitos y entran en nuevos eritrocitos. Algunas sustancias residuales del parásito y la hemoglobina pasan a través del plasma. La presencia de anemia hemolítica impide la oxigenación adecuada de los tejidos, lo que resulta en la aparición de fallas orgánicas internas. Inevitablemente, cuando el nivel de parasitemia se eleva, conduce a un desenlace fatal. El diagnóstico temprano y preciso es la parte más crítica de las estrategias de control de enfermedades. Durante la fase aguda de la infección, los signos clínicos pueden indicar la enfermedad, y los parásitos pueden ser diagnosticados por un especialista examinando las características morfológicas del parásito bajo un microscopio. Sin embargo, es difícil diagnosticar la enfermedad mediante métodos de examen microscópico y clínico en los casos en que el número de parásitos es bajo (Yeruham et al., 1998; De Vos y otros, 2000; Sevinc et al., 2013).
Los métodos de diagnóstico serológico se han utilizado generalmente para detectar infecciones latentes (Bose et al., 1995; Homero y otros, 2000; Georges y otros, 2001; Bock y otros, 2004; Ceylan y Sevinc, 2020). Los métodos serológicos abarcan tanto las técnicas basadas en anticuerpos, que se emplean principalmente para recopilar información epidemiológica sobre enfermedades, como los métodos de detección de antígenos, que se utilizan para diagnosticar infecciones activas. En los casos en que hay un recuento bajo de parásitos en el cuerpo, los métodos de detección de antígenos aún pueden identificar las proteínas secretadas por los parásitos. En consecuencia, estos métodos exhiben una mayor sensibilidad en comparación con la microscopía directa para el diagnóstico preciso de infecciones en curso (Montealegre et al., 1987; Chen y otros, 2008; Luo et al., 2012).
Nuestro grupo ha descrito recientemente una proteína inmunorreactiva denominada rBoSA1 (antígeno-1 secretado por B. ovis recombinante) a partir de B. ovis. Encontramos que esta proteína tenía fuertes estructuras antigénicas para detectar anticuerpos anti-B. ovis. Además, determinamos que la proteína nativa BoSA1 era abundante en el citoplasma de eritrocitos infectados y corroboramos que esta proteína también era detectable en el plasma de animales infectados con B. ovis mediante análisis de Western blot (Sevinc et al., 2015). Se predice que esta proteína secretora única se liberará a la circulación de los glóbulos rojos infectados debido a la hemólisis intravascular durante el desarrollo asexual del parásito. Las infecciones activas podrían diagnosticarse mediante la detección de esta proteína secretora a través de un método serológico basado en la detección de antígenos. Por lo tanto, el presente estudio tuvo como objetivo desarrollar una técnica ELISA sándwich para detectar la proteína BoSA1 nativa en muestras de suero y sangre de ovejas con infección activa por B. ovis.
Materiales y métodos
Muestras de sangre, ovejas infectadas natural y experimentalmente
Un centenar de ovejas infectadas naturalmente y 15 corderos esplenectomizados infectados experimentalmente fueron incluidos en el estudio. Las infecciones naturales fueron de los casos clínicos detectados en la parte central de Türkiye (Sevinc et al., 2013). Los corderos experimentales se sometieron a esplenectomía utilizando técnicas quirúrgicas establecidas, como se describe en el estudio anterior (Sevinc et al., 2007). Los sueros preinmunes se recolectaron de los corderos antes de iniciar la infección experimental. De las 15 infecciones experimentales, 13 se realizaron mediante inoculación intravenosa de sangre infectada con B. ovis (Sevinc et al., 2007; Sevinc et al., 2014). El dipropionato de imidocarb (1,2 mg/kg) se utilizó para tratar a los animales que desarrollaron parasitemia durante estas infecciones. Las 2 infecciones experimentales restantes fueron llevadas a cabo por Rhipicephalus bursa adulto no alimentado infectado con B. ovis en corderos Romanov de Anatolia de 5-6 meses de edad. Los corderos fueron comprados en el distrito de Baskil, ubicado en la provincia de Elaziğ de Türkiye, y alojados en un corral cerrado en las instalaciones de animales de Medicina Veterinaria. Las muestras de sangre tomadas de los corderos antes del experimento se sometieron a análisis microscópicos, serológicos y moleculares, y se confirmó que los corderos estaban libres de parásitos sanguíneos, incluido B. ovis, antes de ser infestados con garrapatas infectadas. Para el experimento se utilizó la línea de garrapata R. bursa infectada no alimentada que continúa en el Departamento de Parasitología de la Facultad de Veterinaria de la Universidad de Firat.
Infección experimental en corderos por R. bursa adulta no alimentada infectada con B. ovis
Para establecer el plazo para detectar BoSA1 nativa en el torrente sanguíneo, se colocaron 90 y 100 adultos no alimentados con R. bursa infectados con B. ovis en el cordero esplenectomizado 1 y cordero 2, respectivamente (Erster et al., 2016). Las garrapatas infectadas se alimentaban de corderos hasta su reposición en las cápsulas de plástico pegadas a la espalda de los animales (Almazán et al., 2018). Después de que se adhirieron las garrapatas infectadas, los corderos fueron monitoreados periódicamente para detectar el progreso de la infección. Durante el experimento, los hallazgos clínicos y la temperatura corporal de cada cordero se verificaron diariamente. Simultáneamente, se recolectaron frotis de sangre delgada, muestras de sangre EDTA y sueros para examen microscópico, PCR y ELISA sándwich basado en anticuerpos policlonales específicos de rBoSA1, respectivamente.
Detección microscópica de Babesia ovis
Los animales sospechosos de tener la enfermedad fueron examinados primero clínicamente, seguidos de una pequeña incisión desde la punta de la oreja de los animales. Se extrajeron unas gotas de sangre de estas incisiones y se prepararon los frotis de sangre delgada. Los frotis preparados se tiñeron con una solución de Giemsa al 10% durante al menos 30 minutos después de la fijación con metanol durante 5 minutos. El nivel de parasitemia se determinó examinando al menos 20 campos de microscopio. Los niveles de parasitemia se clasificaron de acuerdo con la literatura relevante de la siguiente manera: 1: parasitemia baja (0.1-0.3%), 2: parasitemia moderada (0.4-0.9%), 3: parasitemia alta (1-2.5%) y 4: parasitemia muy alta (>2.5%) (Sevinc et al., 2013). Se recogieron muestras de sangre de la vena yugular de los corderos utilizando tubos de vacío recubiertos de anticoagulante (EDTA) y no anticoagulantes. Los sueros se separaron por centrifugación y se almacenaron en un congelador de -20 ° C hasta su uso. El análisis de PCR para la detección del ADN de B. ovis se realizó como se describió anteriormente (Aktas et al., 2005).
Producción de proteína BoSA1 recombinante
La expresión de la proteína rBoSA1 de las células de E. coli DH5α y su purificación se prepararon como se informó en el estudio anterior (Sevinc et al., 2015).
Inmunizaciones de ratones y conejos
Para producir los anticuerpos de captura y detección, se utilizaron doce ratones ICR libres de patógenos específicos (SPF) de 6 semanas de edad (CLEA, Japón) y un conejo blanco que pesaba 2,5 kg para generar anticuerpos policlonales anti-rBoSA1. Los ratones fueron inmunizados inyectando 100 microgramos (μg) de rBoSA1 purificado por vía intraperitoneal después de emulsionar con un volumen igual de adyuvante completo de Freud (Sigma-Aldrich, EE. A los 14 y 28 días después de la primera inmunización, la misma cantidad de antígeno se emulsionó con el adyuvante incompleto de Freud (Sigma-Aldrich, EE.UU.), y los ratones recibieron una segunda y tercera inmunización por inyección intraperitoneal nuevamente. En la inmunización con conejos, se administró 1 mg de antígeno rBoSA1 purificado por vía subcutánea a diferentes puntos del cuerpo del conejo, con emulsiones hechas con adyuvantes completos e incompletos de Freud, como en ratones. Las inmunizaciones de conejos se realizaron tres veces con un intervalo de dos semanas, como en los ratones. La sangre entera de ratones y conejos inmunizados con antígeno se recolectó 14 días después de la última inmunización, y los sueros inmunes se extrajeron por centrifugación. Los anticuerpos policlonales IgG anti-rBoSA1 en sueros de ratones y conejos se purificaron utilizando el kit de proteína A Econo-Pac (BioRad Laboratories, EUA) (Luo et al., 2012). Los anticuerpos purificados se almacenaron en un congelador profundo de -30 ° C y luego se utilizaron en el método ELISA sándwich.
Determinación del límite de detección de la proteína BoSA1 nativa mediante ELISA sándwich
Para determinar el límite mínimo de detección del ELISA sándwich basado en anticuerpos policlonales específicos de rBoSA1, se probaron diluciones dobles a partir de una concentración de 200 μg/ml de rBoSA1 en ELISA sándwich.
Aplicaciones ELISA sándwich
El ensayo ELISA sándwich se optimizó probando diferentes diluciones de IgG policlonales anti-rBoSA1 de conejo y ratón y anticuerpos secundarios marcados con enzimas (IgG anti ratón de cabra conjugada con HRP, laboratorio de Bethyl, EE. Se utilizaron veinte muestras de suero y sangre recogidas de corderos sanos para establecer un punto de corte específico de BoSA1 para el ELISA sándwich. El valor de corte se calculó de acuerdo con la fórmula de la densidad óptica media de las muestras negativas más 2 veces la desviación estándar. La microplaca ELISA se incubó primero a 4 °C durante la noche con 100 μl de anticuerpos anti-rBoSA1 de conejo diluidos con tampón carbonato-bicarbonato (tampón carbonato-bicarbonato 0,05 M, pH 9,6) a una concentración de 2 μg/ml y luego se bloqueó en una incubadora de 37 °C con solución salina tamponada con fosfato (PBS) que contenía una solución de leche desnatada en polvo al 5% (Sigma-Aldrich) durante 1 h. Después de un lavado con PBST (solución salina tamponada con fosfato con Triton-X), se añadieron 100 μl de las muestras de control positivo/negativo y muestras de suero/sangre de animales infectados con dilución de 1/5 y se incubaron a 37 °C durante 1 h. Luego, se realizaron seis lavados con PBST nuevamente. Se incubó con anticuerpos anti-rBoSA1 de ratón diluidos con solución de leche descremada al 5% a una concentración de 2 μg/ml a 37°C durante 1 h. Se repitieron seis lavados más con PBST, y finalmente, la placa se incubó con la IgG de ratón (Bethyl, USA) conjugada con peroxidasa de rábano picante (HRP) diluida con solución de leche descremada al 5% en una proporción de 1/8000 a 37 ° C durante 1 h. Los pocillos se volvieron a lavar y se añadió 100 μl de sustrato ABTS (2,2′-azino-bis (ácido 3-etilbenzotiazolina-6-sulfónico)) (Sigma-Aldrich, EE.UU.) a cada pocillo, y luego la placa se mantuvo en la oscuridad durante 30 minutos. La intensidad de la reacción enzimática se cuantificó utilizando el filtro de 415 nm del lector de microplacas ELISA (Rayto RT-2100C, China). Se utilizó proteína BoSA1 recombinante purificada como control positivo en el ELISA sándwich.
Control de la reactividad cruzada serológica
Para determinar la especificidad del método ELISA sándwich, se probaron varias muestras de suero positivas para piroplasma, incluyendo B. bovis, B. bigemina, B. caballi, B. canis, B. gibsoni, Theileria equi y T. annulata en términos de proteína nativa BoSA1.
Análisis estadístico
La correlación entre el nivel de parasitemia de la infección por B. ovis y la densidad óptica (valor OD) de la proteína nativa BoSA1 en el ELISA sándwich se investigó estadísticamente utilizando el método de análisis estadístico de correlación de Spearman. El SPSS 25 (IBM Corp. lanzado en 2017. IBM SPSS Statistics para Windows, Versión 25.0. Armonk, NY: IBM Corp.) Se adoptó el programa de paquete estadístico para analizar los datos. Se calcularon valores p para determinar el nivel de significación estadística. El nivel de significancia fue indicado como p < 0,05.
Declaración ética
Todas las aplicaciones realizadas en animales se realizaron de acuerdo con las condiciones definidas en las instrucciones del comité ético local del Centro de Investigación y Aplicación de Medicina Experimental de la Universidad de Selcuk (Aprobación ética: 2016-35) y la Universidad de Firat (Aprobación ética: 2021/12). La sangre de conejo y ratón se recogió bajo sedación mediante 5 mg/kg de clorhidrato de xilazina intramuscular (Rompun, Bayer) + 30-40 mg/kg de clorhidrato de ketamina (Ketalar, Pfizer). Después de que se tomó la sangre, el conejo fue sacrificado por decapitación cervical, y los ratones fueron sacrificados por dislocación cervical.
Resultados
Límite de detección de BoSA1 por ELISA sándwich
Al analizar 24 diluciones seriadas a partir de una concentración de 200 μg / ml de rBoSA1, se encontró que el ELISA sándwich tenía una sensibilidad muy alta para detectar proteínas rBoSA1. La cantidad detectable más baja de rBoSA1 fue de 1,52 ng/ml. La información detallada se ilustra en la Figura 1.
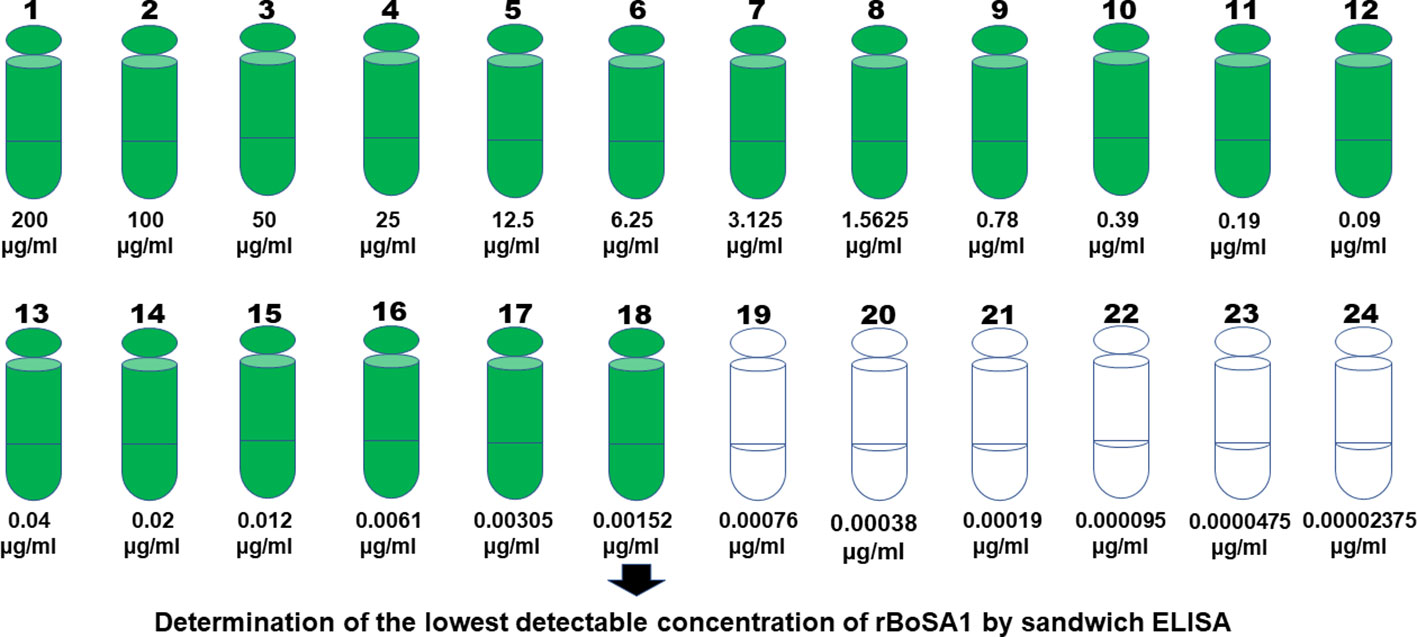 Figura 1 Veinticuatro diluciones seriadas de rBoSA1 para determinar la concentración detectable más baja por ELISA sándwich.
Figura 1 Veinticuatro diluciones seriadas de rBoSA1 para determinar la concentración detectable más baja por ELISA sándwich.
La presencia de proteína BoSA1 nativa en las ovejas infectadas naturalmente
Para determinar la sensibilidad del método, las muestras tomadas de 100 ovejas infectadas naturalmente se examinaron para detectar la presencia de la proteína nativa BoSA1 mediante ELISA sándwich. El punto de corte calculado a partir de corderos sanos fue de 0,477 para sueros y 0,396 para sangre. Se detectó proteína BoSA1 nativa circulante en 98 y 97 de las muestras de suero y sangre, respectivamente. Mientras que los valores de OD por encima de 0,477 y 0,396 en sueros y sangre infectados se detectaron respectivamente, estaba muy por debajo de estos límites en las muestras negativas. Los resultados del ELISA sándwich de todas las muestras de suero y sangre tomadas de animales infectados naturalmente se ilustran en la Figura 2.
 Figura 2 Sandwich ELISA da como resultado las muestras de suero y sangre de ovejas infectadas naturalmente. (A) valores de DO de muestras de suero, (B) valores de OD de muestras de sangre.
Figura 2 Sandwich ELISA da como resultado las muestras de suero y sangre de ovejas infectadas naturalmente. (A) valores de DO de muestras de suero, (B) valores de OD de muestras de sangre.
La dinámica de la proteína nativa BoSA1 en corderos infectados experimentalmente
Las muestras de suero de corderos infectados experimentalmente mostraron reacciones positivas desde el primer y segundo día de las inoculaciones de sangre infectadas. La proteína nativa BoSA1 se detectó el primer día después de la inoculación de sangre infectada con B. ovis en doce de las trece muestras, y todos los corderos fueron positivos en el segundo día de inoculación. La densidad de proteína continuó hasta el tiempo de tratamiento con altos valores de OD. La proteína nativa BoSA1 comenzó a desaparecer el primer día de administración del fármaco (1,2 mg/kg de dipropionato de imidocarb), que correspondió principalmente al cuarto día de infección experimental, y todas las muestras fueron negativas durante el período posterior al tratamiento. En la Figura 1 se proporciona información detallada sobre la dinámica de la proteína BoSA3 nativa en los corderos infectados experimentalmente por la inoculación de sangre infectada por B. ovis.
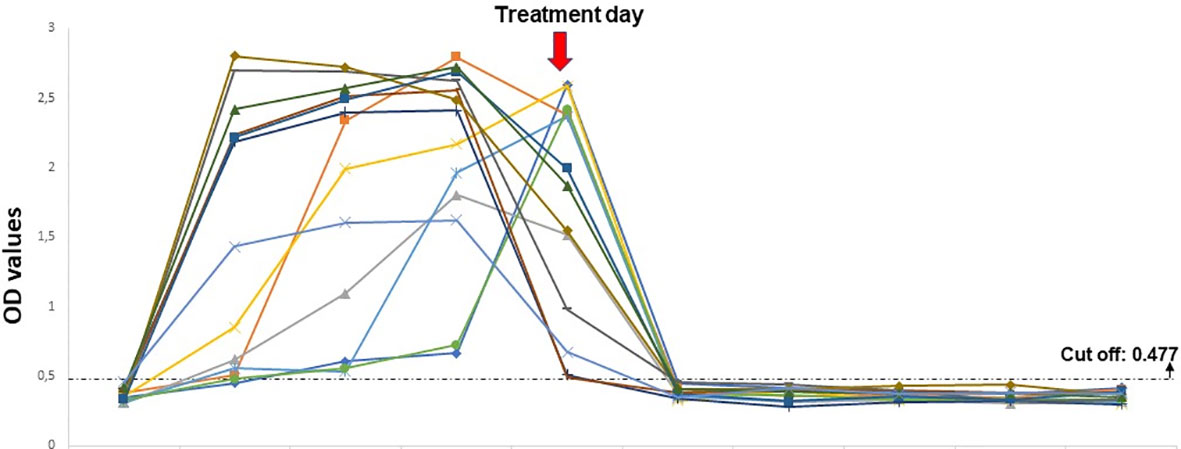 Figura 3 La dinámica de la proteína nativa BoSA1 en las infecciones experimentales realizadas por la inoculación de sangre infectada con B ovis. El eje horizontal representa los días previos y posteriores a la inoculación.
Figura 3 La dinámica de la proteína nativa BoSA1 en las infecciones experimentales realizadas por la inoculación de sangre infectada con B ovis. El eje horizontal representa los días previos y posteriores a la inoculación.
La dinámica de BoSA1 nativa en la infección experimental por R. bursa adulta no alimentada infectada con B. ovis
Este experimento se agregó al estudio para averiguar el tiempo de detección de la proteína nativa BoSA1 en la sangre de los animales después de la fijación de garrapatas. La información que se obtendrá de este experimento será extremadamente importante para el diagnóstico de la infección en condiciones de campo. Ambos corderos esplenectomizados infestados adultos no alimentados con R. bursa infectados con B. ovis desarrollaron babesiosis clínica grave, incluyendo anemia, hemoglobinuria, fiebre alta y parasitemia alta de 7,1% (cordero 1) y 42,5% (cordero 2). Ambos corderos murieron 13 días después de la infestación por garrapatas, dentro de los 3-4 días posteriores al inicio de la parasitemia (Tabla 1). En las infecciones llevadas a cabo por garrapatas R. bursa infectadas por B. ovis, se pudo detectar BoSA1 nativa de las 7ésimo día de la unión a la garrapata mediante ELISA sándwich basado en anticuerpos policlonales específicos de rBoSA1. El momento de aparición de la proteína rBoSA1 casi correspondió al día en que los merozoítos de B. ovis comenzaron a aparecer microscópicamente en la sangre. La detección del ADN del parásito por PCR fue 1-3 días antes del momento de detección de proteínas. El valor de DO fue superior al punto de corte en el séptimo día y aumentó en los días siguientes, excepto por una infección experimental con parasitemia baja. En la Tabla 1 se proporciona información detallada sobre los resultados del ELISA sándwich de infecciones experimentales transmitidas por garrapatas R. bursa.
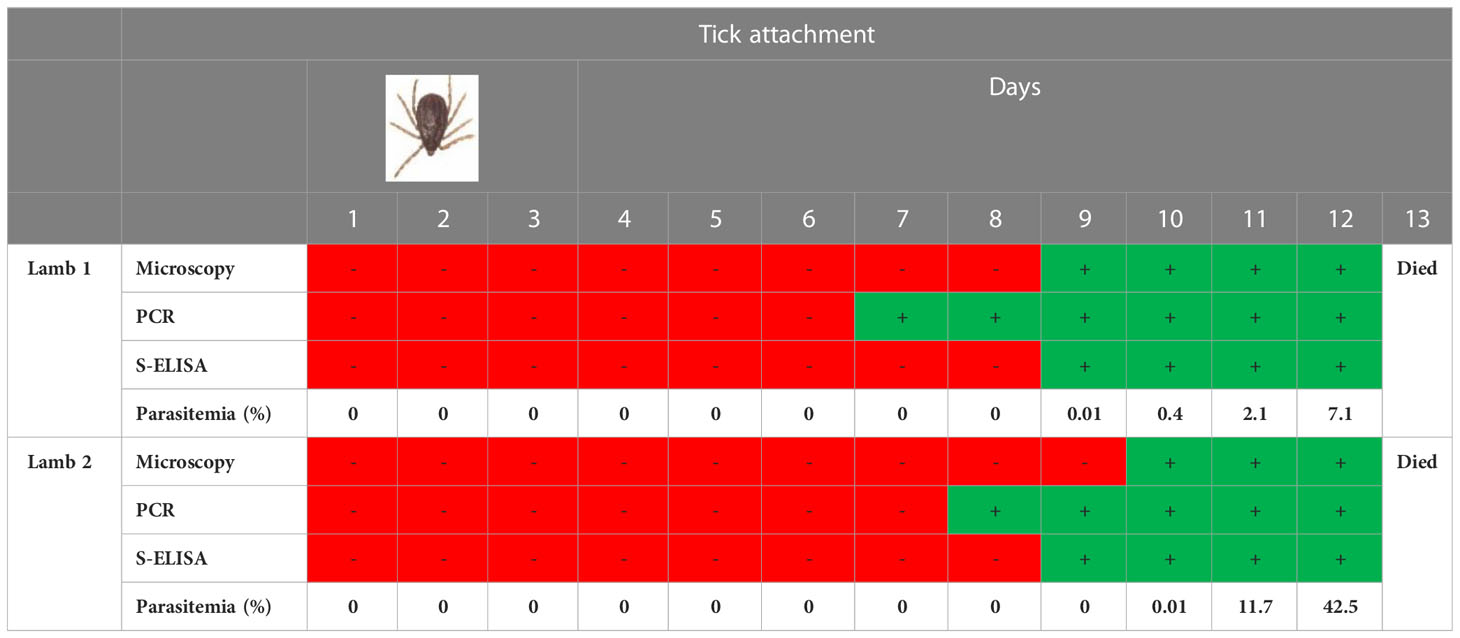 Cuadro 1 Sandwich ELISA resultados de infecciones experimentales transmitidas por garrapatas R. bursa.
Cuadro 1 Sandwich ELISA resultados de infecciones experimentales transmitidas por garrapatas R. bursa.
Reactividad cruzada
No hubo reactividad cruzada contra anticuerpos policlonales anti-rBoSA1 en los sueros de varios animales infectados con especies de piroplasma, incluyendo B. bovis, B. bigemina, B. caballi, B. canis, B. gibsoni, T. equi y T. annulata.
Correlación positiva entre el nivel de parasitemia y el valor de OD
Se determinó una relación estadísticamente significativa entre los niveles de parasitemia y los valores de OD de las muestras de suero y sangre de animales infectados naturalmente. Se observó que el valor de DO aumentó a medida que aumentaba el nivel de parasitemia, y el valor de DO disminuía a medida que disminuía el nivel de parasitemia. Los gráficos obtenidos del análisis de correlación de Spearman se muestran en la Figura 4.
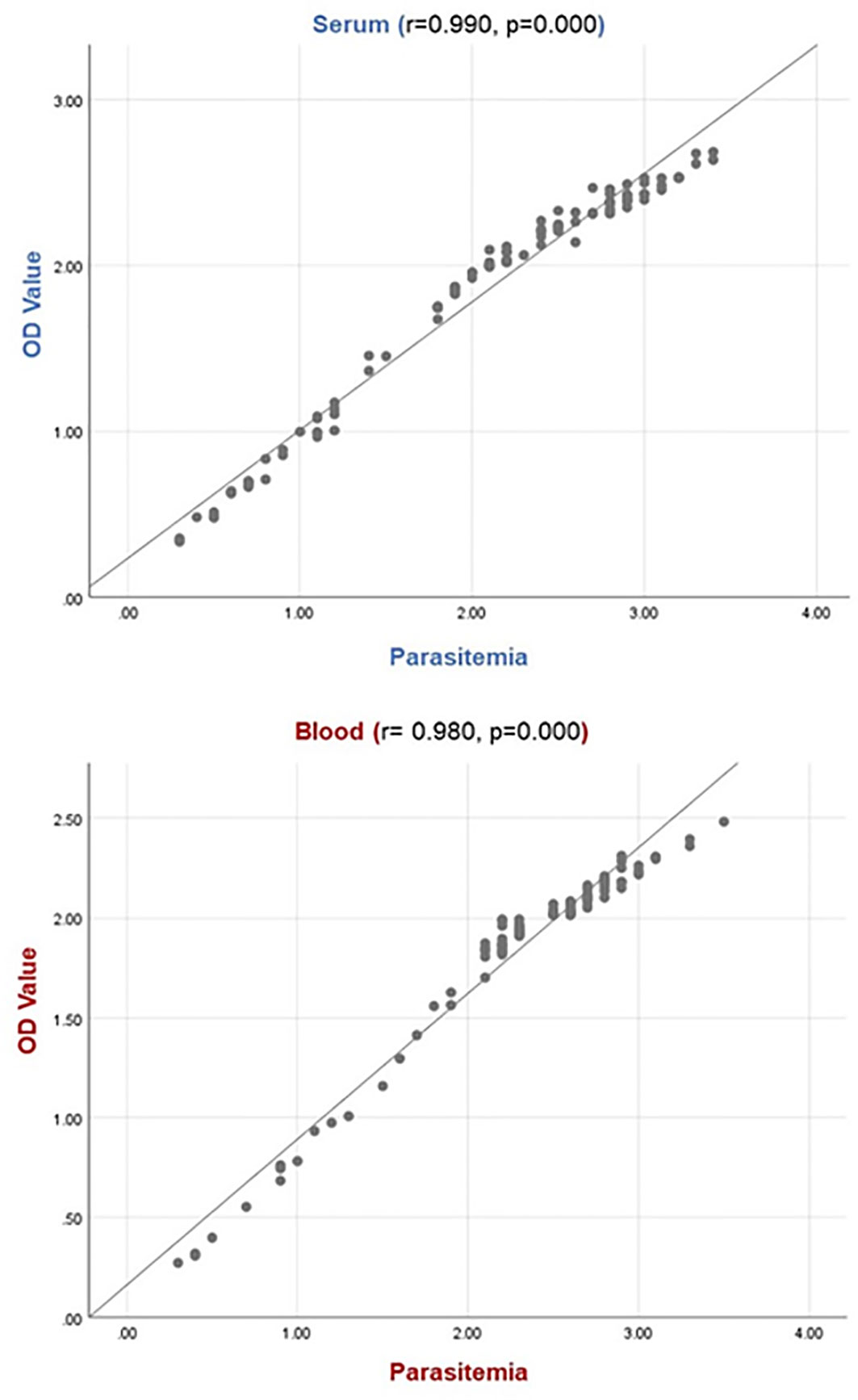 Figura 4 Relación entre el valor de OD y el nivel de parasitemia. La relación entre la carga parasitaria y el valor de OD indica que existe una correlación positiva para muestras de suero (r: 0,990, p: 0,000) y muestras de sangre (r: 0,980, p: 0,000). Para la línea de parasitemia: 1, 2, 3 y 4 indican los niveles de parasitemia bajos (0,1-0,3%), moderados (0,4-0,9%), altos (1-2,5%) y muy altos (>2,5%), respectivamente.
Figura 4 Relación entre el valor de OD y el nivel de parasitemia. La relación entre la carga parasitaria y el valor de OD indica que existe una correlación positiva para muestras de suero (r: 0,990, p: 0,000) y muestras de sangre (r: 0,980, p: 0,000). Para la línea de parasitemia: 1, 2, 3 y 4 indican los niveles de parasitemia bajos (0,1-0,3%), moderados (0,4-0,9%), altos (1-2,5%) y muy altos (>2,5%), respectivamente.
Discusión
La babesiosis ovina generalmente se asocia con mortalidad y morbilidad en pequeños rumiantes. El período de incubación después de la fijación de la garrapata es de alrededor de dos semanas. Al final de este período, la temperatura corporal aumenta hasta 40-42 ° C. La pérdida de apetito y la depresión se observan en animales. La respiración y el pulso se elevan debido a la anemia hemolítica debido a la descomposición de los glóbulos rojos, y se observan hemoglobinemia, hemoglobinuria e ictericia. Las manifestaciones que incluyen la presencia de heces con sangre, temblores musculares y parálisis de las piernas se pueden observar como síntomas de la infección. En los casos de babesiosis aguda, si no se trata, la enfermedad puede conducir a la muerte, siendo la causa principal de muerte típicamente la anoxia resultante de la anemia (Yeruham et al., 1998). Los eritrocitos son la primera y única área de asentamiento de las especies Babesia en huéspedes vertebrados. Los merozoítos de Babesia ovis se desarrollan dividiéndose en dos o más eritrocitos, descomponen los eritrocitos y entran en otros eritrocitos para poder continuar el desarrollo asexual. Como resultado de una serie de reproducción asexual, la mayoría de los eritrocitos se infectan y algunas sustancias residuales del parásito pasan a través del plasma (Yeruham et al., 1998; Uilenberg, 2006; Sevinc et al., 2013).
Las proteínas secretoras que se encuentran en las estructuras del parásito son los recursos más ricos para nuevas dianas terapéuticas farmacológicas, antígenos diagnósticos y candidatos a vacunas (Bonin-Debs et al., 2004; Ceylan et al., 2022). Las proteínas del parásito secretadas en la célula huésped desempeñan un papel vital en la modificación de la célula huésped y proporcionan la interacción entre el sistema inmune del huésped y los parásitos apicomplejos, incluidos los protozoos intracelulares como Toxoplasma, Plasmodium y Theileria (Ravindran y Boothroyd, 2008). Durante el desarrollo asexual de las especies de Babesia en los eritrocitos, se liberan proteínas del parásito y se pueden encontrar tanto en el citoplasma de los eritrocitos como en el plasma sanguíneo. La mayoría de estas proteínas del parásito son capaces de provocar una respuesta inmune. Significa que estimulan el sistema inmunológico mediante la activación de factores de defensa celulares y humorales cuando se secretan. Por lo tanto, las proteínas inmunorreactivas son las moléculas diana utilizadas para diagnosticar enfermedades (Sahagún Ruiz et al., 2000; Kumar y otros, 2002; Huang y otros, 2006; Terkawi y otros, 2007; Goo y otros, 2008; Ramos y otros, 2009; Ooka y otros, 2011; Ceylan et al., 2022).
El éxito del tratamiento de la infección por B. ovis depende de un diagnóstico precoz y preciso. Durante una infección aguda, la enfermedad se diagnostica observando los síntomas clínicos relacionados con la babesiosis y analizando las estructuras morfológicas de los merozoítos en los eritrocitos. Sin embargo, hay algunas enfermedades que se confunden con la babesiosis debido a la similitud de los signos clínicos, como la leptospirosis, la anaplasmosis y la intoxicación por cobre. Además, los parásitos no son demostrables en la sangre bajo un microscopio, especialmente en el caso de infecciones subclínicas. Se han utilizado varios métodos de detección de anticuerpos serológicos para detectar infecciones latentes o subclínicas con baja parasitemia (Bose et al., 1995; Georges y otros, 2001; Bock y otros, 2004). La prueba de anticuerpos de fluorescencia indirecta (IFA) es un método sensible para el diagnóstico serológico de la babesiosis (Homer et al., 2000). Factores como la aparición de reacciones cruzadas entre diferentes especies (Bose et al., 1995), la falta de procedimientos de prueba automatizados, la evaluación semicuantitativa de los resultados y la necesidad de un microscopio especializado y de fluorescencia para evaluar los resultados se encuentran entre las desventajas de la prueba IFA. Se han utilizado varios métodos ELISA para detectar anticuerpos específicos contra especies de Babesia como B. bovis, B. bigemina, B. divergens, B. caballi, B. canis, B. gibsoni, B. microti y Babesia sp. Xinjiang (Bose et al., 1990; Kappmeyer y otros, 1999; Ikadai y otros, 2000; Fukumoto y otros, 2001; Boonchit y otros, 2002; Goff y otros, 2003; Goff y otros, 2006; Goff y otros, 2008; Niu y otros, 2016; Chung et al., 2017; Ortiz et al., 2018). Recientemente, se han desarrollado técnicas ELISA sándwich basadas en la detección de antígenos para el diagnóstico de infecciones por parásitos sanguíneos (De Arruda et al., 2004; Dondorp y otros, 2005; Chen et al., 2008), incluyendo infecciones por B. bovis y B. microti (Montealegre et al., 1987; Luo y otros, 2012; Thekkiniath et al., 2018). La revisión de la literatura mostró que no existe una prueba diagnóstica comercial basada en la detección de antígenos en el diagnóstico de la babesiosis ovina causada por B. ovis. Nuestro grupo ha identificado recientemente una proteína secretora denominada antígeno 1 secretado por B. ovis-recombinante (rBoSA1) de B. ovis. Se caracterizó como una proteína inmunorreactiva que puede usarse para desarrollar métodos serológicos para diagnosticar babesiosis en ovejas, y los resultados del ensayo de inmunofluorescencia revelaron que la proteína nativa BoSA1 ubicada en la superficie y el interior de los merozoítos de B. ovis y el parásito secretaron intensamente la proteína al citoplasma de los eritrocitos infectados (Sevinc et al., 2015). Estas proteínas circulantes de B. ovis pueden detectarse antes que la formación de anticuerpos específicos en la sangre mediante un método basado en la detección de antígenos, y pueden servir como biomarcadores en el diagnóstico precoz de la infección por B. ovis. Este estudio se llevó a cabo para detectar la proteína BoSA1 nativa en las muestras de sangre y suero de los animales infectados utilizando la técnica ELISA sándwich y, finalmente, Diagnosticar babesiosis en ovejas durante la infección activa. La técnica ELISA sándwich se aplicó utilizando anticuerpos policlonales específicos para la proteína BoSA1 recombinante. Los anticuerpos policlonales anti-rBoSA1 detectaron la proteína BoSA1 nativa circulante con alta sensibilidad en el 98% de los animales, que fueron positivos para infección por B. ovis mediante microscopía y análisis de PCR (Figura 2). En ELISA, solo dos muestras de suero de animales infectados naturalmente fueron negativas. Hubo una correlación estadísticamente positiva entre los valores de OD de estas muestras y los niveles de parasitemia. Nuestro estudio anterior (Sevinc et al., 2015) mostró que el 68,42% de las ovejas infectadas naturalmente fueron positivas para anticuerpos específicos de B. ovis durante las infecciones activas. Se infiere que la técnica ELISA sándwich es más sensible que el ELISA indirecto en la detección de infecciones clínicas. Los anticuerpos, los elementos básicos de la defensa humoral, generalmente se ven en circulación hacia las últimas etapas de las infecciones agudas y continúan existiendo en el cuerpo durante varios años. Por lo tanto, la detección de los anticuerpos específicos del parásito en circulación indica que el parásito infecta al huésped; sin embargo, no proporciona ninguna información sobre el tiempo de infección. Por otro lado, la detección de una proteína específica del parásito en la sangre indica que la infección originada por el parásito todavía existe en el cuerpo. Por lo tanto, se deben utilizar métodos basados en la detección de antígenos para diagnosticar infecciones activas, en lugar de métodos serológicos basados en la detección de anticuerpos.
Además, los sueros de 13 corderos infectados experimentalmente con sangre infectada con B. ovis mostraron una reacción positiva, a valores de OD superiores a 0,477, desde el primer o segundo día de infecciones experimentales. Los valores de OD de BoSA1 nativa aumentaron progresivamente en el período agudo. En este período, los merozoítos de B. ovis se propagaron asexualmente rápidamente (Figura 3). Luego, los valores de OD disminuyeron significativamente en el 1c Día posterior al tratamiento después de la administración de dipropionato de imidocarb (1,2 mg/kg) y disminuyó por debajo del valor de corte en el 2Nd día post-tratamiento (Figura 3). Cuando estos resultados se compararon con los estudios previos (Sevinc et al., 2007; Sevinc et al., 2014; Sevinc et al., 2015) donde se podrían detectar anticuerpos específicos de B. ovis, en el 7ésimo o 8ésimo días de infecciones experimentales por inoculación sanguínea, el ELISA sándwich es más sensible que el ELISA indirecto para el diagnóstico precoz de infecciones clínicas. Por otro lado, las infecciones experimentales inducidas por garrapatas R. bursa infectadas por B. ovis, imitando la infección natural, se detectó BoSA1 nativa en el suero sanguíneo de los 7ésimo Día de Tick Attachment. Se comparó el tiempo de detección de la proteína BoSA1 nativa en sueros y la aparición de merozoítos de B. ovis en frotis de sangre fina teñidos con Giemsa. En consecuencia, mientras que el cordero1 se encontró positivo para la presencia de la proteína nativa BoSA1 en el día del tiempo de detección microscópica de merozoítos, lamb2 mostró positividad en Sandwich ELISA un día antes de la detección de merozoítos de B. ovis (Tabla 1). La detección del ADN del parásito por PCR fue uno o dos días antes de la detección de proteínas. Todos los experimentos realizados sugieren que BoSA1 nativo es un indicador prometedor para detectar infecciones por B. ovis en etapa temprana, y la nueva técnica ELISA sándwich descrita en el estudio es un método mucho más sensible para diagnosticar infecciones activas por B. ovis en comparación con los ensayos de detección de anticuerpos.
Se probaron diluciones seriadas de rBoSA1 para determinar el límite de detección más bajo de ELISA sándwich. Como resultado de la prueba, el ELISA sándwich fue altamente sensible para detectar tan solo 1,52 ng de proteína rBoSA1 en 1 ml de solución (Figura 1). Además, hubo una correlación significativamente positiva entre los valores de OD y los niveles de parasitemia (r: 0,980, p: 0,000 para sangre, r: 0,990, p: 0,000 para suero) en el presente estudio (Figura 4). Hallazgos similares fueron reportados por Joshi et al. (2004) en infecciones por Plasmodium vivax en humanos, y por Luo et al. (2012) en infecciones por B. microti de hámsteres. Luo et al. (2012) revelaron que el antígeno 1 secretado por Babesia microti circulante (BmSA1) se superpone con el perfil de parasitemia durante las infecciones activas en un modelo de hámster. Se concluye que el ELISA sándwich basado en anticuerpos policlonales específicos de rBoSA1 puede proporcionar información sobre la gravedad de las infecciones agudas y la carga de B. ovis en circulación en la evaluación clínica de la babesiosis ovina.
La principal desventaja de las pruebas serológicas son las reacciones cruzadas (Jiang et al., 2021). Para reducir la posibilidad de reacción cruzada, las fracciones antigénicas del parásito en la circulación del huésped deben usarse en métodos serológicos (Petray et al., 1992; Chen y otros, 2008). No se detectó reactividad cruzada contra anticuerpos policlonales anti-rBoSA1 en sueros de diferentes especies animales que fueron positivas para los parásitos apicomplejos, incluidos B. bovis, B. bigemina, B. caballi, B. canis, B. gibsoni, T. equi y T. annulata en este estudio. Este resultado indicó que la proteína nativa BoSA1 no tiene determinantes antigénicos comunes con las especies de piroplasma antes mencionadas, y es una proteína inmunorreactiva fuerte específica para B. ovis. Los hallazgos indican que esta nueva técnica ELISA sándwich puede diagnosticar con éxito la babesiosis ovina causada por B. ovis durante la infección activa sin reacción cruzada.
En conclusión, este es el primer estudio sobre la técnica ELISA sándwich para diagnosticar la infección por B. ovis en su fase activa. Mediante ELISA sándwich, se capturó proteína BoSA1 nativa en casi todas las muestras examinadas con alta sensibilidad y especificidad en ovejas. Cuando se evalúan los resultados ELISA de las muestras positivas y negativas analizadas en este estudio, se observa que la sensibilidad es del 98,26% (113 de un total de 115 muestras infectadas de forma natural y experimental) y la especificidad es del 100% (todas las 20 muestras negativas examinadas para el cálculo del corte). El diagnóstico precoz es crucial para controlar la infección por B. ovis, que es especialmente común en países tropicales y subtropicales y causa muertes en ovejas (Sevinc et al., 2018; Ceylan y Sevinc, 2020). La aplicación de la técnica ELISA sándwich basada en anticuerpos policlonales específicos de rBoSA1 arrojó hallazgos notables sobre el momento de la detección de la proteína BoSA1 nativa en infecciones experimentales inducidas a través de la inoculación de sangre infectada y garrapatas R. bursa infectadas con B. ovis. Los hallazgos del estudio demuestran que el método ELISA sándwich basado en anticuerpos policlonales específicos de rBoSA1 se puede emplear con éxito y confiabilidad para la detección temprana de infecciones agudas por B. ovis. Además, tiene el potencial de ser utilizado en la evaluación de la eficacia terapéutica de los medicamentos.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio / repositorios y el número (s) de acceso se pueden encontrar en el artículo / material complementario.
Declaración ética
Los estudios en animales fueron aprobados por el comité ético local del Centro de Investigación y Aplicación de Medicina Experimental de la Universidad de Selcuk (Aprobación ética: 2016-35) y la Universidad de Firat (Aprobación ética: 2021/12). Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
FS, MZ, SC y XX diseñaron el estudio. FS, MZ, SC, OC, MU, SO y MA realizaron los experimentos y analizaron los resultados. FS y OC escribieron el borrador del manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
Este trabajo recibió apoyo financiero de los Proyectos de Investigación Científica de la Universidad de Selcuk (BAP-18401055). La infección experimental en corderos con garrapatas infectadas con B. ovis de este estudio fue apoyada por el Programa de Subvenciones del Consejo Científico y Tecnológico de Turkiye (TUBITAK) (número de proyecto 222O123).
Reconocimientos
Los experimentos de inmunización de conejos y ratones se realizaron en el Centro Nacional de Investigación de Enfermedades Protozoarias de la Universidad de Agricultura y Medicina Veterinaria de Obihiro, Japón.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
Aktas, M., Altay, K., Dumanli, N. (2005). Desarrollo de un método de reacción en cadena de la polimerasa para el diagnóstico de la infección por Babesia ovis en ovejas y cabras. Veterinario Parasitol. 133, 277–281. doi: 10.1016/j.vetpar.2005.05.057
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Almazán, C., Bonnet, S., Cote, M., Slovák, M., Park, Y., Šimo, L. (2018). Un modelo versátil de infestación de garrapatas duras en conejos de laboratorio. J. Vis. Exp. 140, E57994. DOI: 10.3791/57994
Bai, Q., Liu, Q. Y., Liu, D. K., Ren, J. X., Li, X. (2002). Aislamiento y caracterización preliminar de una gran Babesia sp. de ovejas y cabras en la parte oriental de la provincia de Gansu, China. Parasitol. Res. 88, S16–S21. DOI: 10.1007/S00436-001-0563-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bock, R., Jackson, L., De Vos, A., Jorgensen, W. (2004). Babesiosis del ganado. Parasitología 129, 247-269. doi: 10.1017/S0031182004005190
Bonin-Debs, A. L., Boche, I., Gille, H., Brinkmann, U. (2004). Desarrollo de proteínas secretadas como agentes bioterapéuticos. Opinión del experto. Biol. Ther. 4, 551–558. doi: 10.1517/14712598.4.4.551
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Boonchit, S., Xuan, X., Yokoyama, N., Goff, W. L., Wagner, G., Igarashi, I. (2002). Evaluación de un ensayo inmunoabsorbente ligado a enzimas con antígeno recombinante de la proteína 1 asociada a la rhoptry frente a Babesia bovis para la detección de anticuerpos específicos en bovinos. J. Clin. Microbiol. 40, 3771–3775. doi: 10.1128/JCM.40.10.3771-3775.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bose, R., Jacobson, R. H., Gale, K. R., Waltisbuhl, D. J., Wright, I. G. (1990). Un ELISA mejorado para la detección de anticuerpos contra Babesia bovis utilizando un antígeno nativo o recombinante de B. bovis. Parasitol. Res. 76 (8), 648–652. doi: 10.1007/BF00931081
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bose, R., Jorgensen, W. K., Dalgliesh, R. J., Friedhoff, K. T., De Vos, A. J. (1995). Estado actual y tendencias futuras en el diagnóstico de la babesiosis. Veterinario Parasitol. 57, 61–74. doi: 10.1016/0304-4017(94)03111-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ceylan, O., Byamukama, B., Ceylan, C., Galon, E. M., Liu, M., Masatani, T., et al. (2021a). Hemoparásitos transmitidos por garrapatas de ovejas: una investigación molecular en Turquía. Patógenos 10, 162. doi: 10.3390/patógenos10020162
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ceylan, O., Ceylan, C., Sevinc, F. (2022). «Proteínas inmunorreactivas: su producción e importancia en enfermedades hemoprotozoarias», en Perspectivas de salud animal, vol. 1. Abbas, R. Z., Khan, A., Liu, P., Saleemi, M. K. (Faisalabad, Pakistan: Unique Scientific Publishers), 114–121.
Ceylan, O., Sevinc, F. (2020). Inestabilidad endémica de la babesiosis ovina en Turquía: un estudio seroepidemiológico a nivel nacional. Veterinario Parasitol. 278, 109034. doi: 10.1016/j.vetpar.2020.109034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ceylan, O., Xuan, X., Sevinc, F. (2021b). Infecciones primarias por protozoos y rickettsiales transmitidas por garrapatas de animales en Turquía. Patógenos 10, 231. doi: 10.3390/patógenos10020231
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chen, R., Lu, S., Lou, D., Lin, A., Zeng, X., Ding, Z., et al. (2008). Evaluación de una técnica ELISA rápida para la detección de antígenos circulantes de Toxoplasma gondii. Microbiol. Immunol. 52, 180–187. doi: 10.1111/j.1348-0421.2008.00020.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Chung, C. J., Suarez, C. E., Bandaranayaka-Mudiyanselage, C. L., Bandaranayaka-Mudiyanselage, C., Rzepka, J., HeiNiger, T., et al. (2017). Un nuevo ELISA modificado-indirecto basado en la proteína esférica del cuerpo 4 para detectar anticuerpos durante infecciones agudas y a largo plazo con diversas cepas de Babesia bovis. Parásito. Vectores 10, 77. DOI: 10.1186/S13071-017-2016-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
De Arruda, M. E., Collins, K. M., Hochberg, L. P., Ryan, P. R., Wirtz, R. A., Ryan, J. R. (2004). Determinación cuantitativa de esporozoítos y antígeno circumsporozoíto en mosquitos infectados por Plasmodium falciparum o P. vivax. Ann. Trop. Med. Parasitol. 98, 121–127. DOI: 10.1179/000349804225003181
Resumen de PubMed | Texto completo de CrossRef | Google Académico
De Vos, A. J., Jorgensen, W. K., Molloy, J. B. (2000). «Bovine babesiosis», en Manual of standards for diagnostic tests and vaccines, 4th ed (Paris: O.I.E.), 412–422.
Dondorp, A. M., Desakorn, V., Pongtavornpinyo, W., Sahassananda, D., Silamut, K., Chotivanich, K., et al. (2005). Estimación de la biomasa total del parásito en la malaria aguda falciparum a partir de PfHRP2 plasmático. PloS Med. 2, e204. doi: 10.1371/journal.pmed.0020204
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Erster, O., Roth, A., Wolkomirsky, R., Leibovich, B., Savitzky, I., Shkap, V. (2016). Transmisión de Babesia ovis por diferentes etapas de desarrollo de Rhipicephalus bursa e inyección de sangre infectada. garrapatas garrapatas transmitidas dis. 7, 13–19. doi: 10.1016/j.ttbdis.2015.07.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Fakhar, M., Hajihasani, A., Maroufi, S., Alizadeh, H., Shirzad, H., Piri, F., et al. (2012). Un estudio epidemiológico sobre la babesiosis bovina y ovina en la provincia de Kurdistán, oeste de Irán. Trop. Anim. Salud Prod. 44 (2), 319–322. DOI: 10.1007/S11250-011-0023-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Fukumoto, S., Xuan, X., Nishikawa, Y., Inoue, N., Igarashi, I., Nagasawa, H., et al. (2001). Identificación y expresión de un antígeno de superficie de 50 kilodalton de Babesia gibsoni y evaluación de su potencial diagnóstico en un ensayo inmunoabsorbente ligado a enzimas. J. Clin. Microbiol. 39 (7), 2603–2609. doi: 10.1128/JCM.39.7.2603-2609.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Georges, K., Loria, G. R., Riili, S., Greco, A., Caracappa, S., Jongejan, F., et al. (2001). Detección de hemoparásitos en bovinos mediante hibridación de transferencia de línea inversa con una nota sobre la distribución de garrapatas en Sicilia. Veterinario Parasitol. 99, 273–286. doi: 10.1016/S0304-4017(01)00488-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Goff, W. L., Johnson, W. C., Molloy, J. B., Jorgensen, W. K., Waldron, S. J., Figueroa, J. V., et al. (2008). Validación de un ensayo inmunoabsorbente competitivo ligado a enzimas para la detección de anticuerpos contra Babesia bigemina en bovinos. Clin. Vacuna Immunol. 15 (9), 1316–1321. doi: 10.1128/CVI.00150-08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Goff, W. L., McElwain, T. F., Suarez, C. E., Johnson, W. C., Brown, W. C., Normine, J., et al. (2003). El ensayo competitivo de inmunoadsorción ligado a enzimas basado en un epítopo de proteína 1 asociado a la roptería identifica específicamente el ganado infectado con Babesia bovis. Clin. Agn. Laboratorio Immunol. 10, 38–43. doi: 10.1128/CDLI.10.1.38-43.2003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Goff, W. L., Molloy, J. B., Johnson, W. C., Suarez, C. E., Pino, I., Rhalem, A., et al. (2006). Validación de un ensayo competitivo de inmunoadsorción ligada a enzimas para la detección de anticuerpos contra Babesia bovis. Clin. Vacuna Immunol. 13, 1212–1216. doi: 10.1128/CVI.00196-06
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Goo, Y. K., Jia, H., Aboge, G. O., Terkawi, M. A., Kuriki, K., Nakamura, C., et al. (2008). Babesia gibsoni: serodiagnóstico de infección en perros mediante un ensayo inmunoabsorbente ligado a enzimas con BgTRAP recombinante. Exp. Parasitol. 118, 555–560. doi: 10.1016/j.exppara.2007.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Guan, G., Ma, M., Moreau, E., Liu, J., Lu, B., Bai, Q., et al. (2009). Una nueva especie ovina de Babesia transmitida por Hyalomma anatolicum. Exp. Parasitol. 122 (4), 261–267. doi: 10.1016/j.exppara.2009.05.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Homer, M. J., Aguilar-Delfin, I., Telford, S. R., III, Krause, P. J., Persing, D. H. (2000). Babesiosis. Clin. Microbiol. Apocalipsis 13 (3), 451–469. doi: 10.1128/CMR.13.3.451
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Huang, X., Xuan, X., Yokoyama, N., Katayama, Y., Anzai, T., Igarashi, I. (2006). Evaluación de ensayos inmunoabsorbentes ligados a enzimas con antígenos recombinantes para el serodiagnóstico de infecciones equinas por Babesia. Veterinario Parasitol. 140, 158–161. doi: 10.1016/j.vetpar.2006.03.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ikadai, H., Osorio, C. R., Xuan, X., Igarashi, I., Kanemaru, T., Nagasawa, H., et al. (2000). Detección de la infección por Babesia caballi mediante ensayo inmunoabsorbente ligado a enzimas utilizando proteína de roptería merozoíta recombinante de 48 kDa. Int. J. Parasitol. 30 (5), 633–635. doi: 10.1016/S0020-7519(00)00008-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Iqbal, F., Fatima, M., Shahnawaz, S., Naeem, M., Shaikh, R., Ali, M., et al. (2011). Estudio sobre la determinación de factores de riesgo asociados a babesiosis y prevalencia de Babesia sp., mediante amplificación por PCR, en pequeños rumiantes del sur de Punjab (Pakistán). Parásito 18 (3), 229–234. doi: 10.1051/parásito/2011183229
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jiang, X., Wu, M., Albo, J., Rao, Q. (2021). Unión no específica y reacción cruzada de ELISA: un estudio de caso de detección de hemoglobina porcina. Alimentos 10, 1708. DOI: 10.3390/alimentos10081708
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Joshi, H. H., Mahakunkijcharoen, Y., Tantivanich, S., Sharma, A. P., Khusmith, S. (2004). Detección de antígenos de P. vivax en poblaciones endémicas de malaria de Nepal por Elisa utilizando anticuerpos monoclonales levantados contra aislados tailandeses. South Asian J. Trop. Med. Public Health 35 (4), 828–833.
Kappmeyer, L. S., Perryman, L. E., Hines, S. A., Baszler, T. V., Katz, J. B., Hennager, S. G., et al. (1999). Detección de anticuerpos equinos contra Babesia caballi mediante la proteína 1 asociada a la rhoptry recombinante de B. caballi en un ensayo inmunoabsorbente ligado a enzimas de inhibición competitiva. J. Clin. Microbiol. 37 (7), 2285–2290. doi: 10.1128/JCM.37.7.2285-2290.2999
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Kumar, S., Malhotra, D. V., Nichani, A. K. (2002). Identificación de polipéptidos inmunorreactivos del parásito Babesia equi durante la inmunización. Veterinario Parasitol. 107, 295–301. doi: 10.1016/S0304-4017(02)00161-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Luo, Y., Terkawi, M. A., Jia, H., Aboge, G. O., Goo, Y. K., Cao, S., et al. (2012). Un ensayo inmunoabsorbente ligado a enzimas en sándwich de doble anticuerpo para la detección del antígeno secretado 1 de Babesia microti utilizando el modelo de hámster. Exp. Parasitol. 130 (2), 178–182. doi: 10.1016/j.exppara.2011.10.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Montealegre, F., Montenegro-James, S., Kakoma, I., Ristic, M. (1987). Detección del exoantígeno Babesia bovis derivado del cultivo mediante un inmunoensayo enzimático de dos sitios. J. Clin. Microbiol. 25, 1648–1652. DOI: 10.1128/JCM.25.9.1648-1652.1987
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Niu, Q., Liu, Z., Yang, J., Yu, P., Pan, Y., Zhai, B., et al. (2016). Expresión del patógeno ovino Babesia sp. Proteína 1 asociada a la rhoptry de Xinjiang y evaluación de su potencial diagnóstico mediante ensayo inmunoabsorbente ligado a enzimas. Parasitología 143 (14), 1990–1999. doi: 10.1017/S0031182016001293
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ooka, H., Terkawi, M. A., Goo, Y. K., Luo, Y., Li, Y., Yamagishi, J., et al. (2011). Babesia microti: caracterizaciones moleculares y antigénicas de una nueva proteína de 94 kDa (BmP94). Exp. Parasitol. 127, 287–293. doi: 10.1016/j.exppara.2010.06.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ortiz, J. M. J., Montenegro, V. N., de la Fourniere, S. A. M., Sarmiento, N. F., Farber, M. D., Wilkowsky, S. E. (2018). Desarrollo de un ELISA indirecto basado en una proteína quimérica recombinante para la detección de anticuerpos contra la babesiosis bovina. Vet. 5, 13. doi: 10.3390/vetsci5010013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ozubek, S., Aktas, M. (2017). Molecular and parasitological survey of ovine piroplasmosis, including the first report of Theileria annulata (Apicomplexa: Theileridae) in Sheep and Goats from Turkey. J. Med. Entomol. 54, 212–220. doi: 10.1093/jme/tjw134
Ozubek, S., Ulucesme, M., Aktas, M. (2023). Discovery of a novel species infecting goats: morphological and molecular characterization of Babesia aktasi n. sp. Pathogens 12, 113. doi: 10.3390/pathogens12010113
Petray, P., Bonardello, N., Clark, R., Agranatti, M., Corral, R., Grinstein, S. (1992). Evaluación de una técnica ELISA para la detección de antígenos y complejos inmunes circulantes de Trypanosoma cruzi mediante un estudio de campo en una zona endémica de Argentina. Reverendo Inst Med. Trop. Sao Paulo 34, 141–147. doi: 10.1590/S0036-46651992000200010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ramos, C. A., Araújo, F. R., Souza, I. I., Oliveira, R. H., Elisei, C., Soares, C. O., et al. (2009). Caracterización molecular y antigénica de la fosfoproteína ribosómica P0 de Babesia bovis. Mem Inst Oswaldo Cruz 104, 998–1002. doi: 10.1590/S0074-02762009000700010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ranjbar-Bahadori, S., Eckert, B., Omidian, Z., Shirazi, N. S., Shayan, P. (2012). Babesia ovis como el principal agente causal de la babesiosis ovina en Irán. Parasitol. Res. 110, 1531–1536. DOI: 10.1007/S00436-011-2658-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ravindran, R., Boothroyd, J. C. (2008). Secreción de proteínas en las células huésped por parásitos apicomplejos. Tráfico 9, 647–656. doi: 10.1111/j.1600-0854.2008.00723.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sahagún Ruiz, A., Waghela, S. D., ROmany, M. M., Holman, P. J., Melendy, D., Cruz, D., et al. (2000). Un antígeno común de alto peso molecular de Babesia bovis aislados de México. Int. J. Parasitol. 30, 59–64. doi: 10.1016/S0020-7519(99)00161-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sevinc, F., Cao, S., Xuan, X., Sevinc, M., Ceylan, O. (2015). Identificación y expresión del antígeno 1 secretado por Babesia ovis y evaluación de su potencial diagnóstico en un ensayo inmunoabsorbente ligado a enzimas. J. Clin. Microbiol. 53 (5), 1531–1536. doi: 10.1128/JCM.03219-14
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sevinc, F., Sevinc, M., Ekici, O. D., Yildiz, R., Isik, N., Aydogdu, U. (2013). Infecciones por Babesia ovis: observaciones clínicas y de laboratorio detalladas en los períodos previos y posteriores al tratamiento de 97 casos de campo. Veterinario Parasitol. 191, 35–43. doi: 10.1016/j.vetpar.2012.07.025
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sevinc, F., Sevinc, M., Koc, Y., Alkan, F., Ekici, O. D., Yildiz, R., et al. (2014). El efecto de 12 pasajes sanguíneos sucesivos sobre la virulencia de Babesia ovis en corderos esplenectomizados: un estudio preliminar. Pequeño Rumin. 116, 66–70. doi: 10.1016/j.smallrumres.2013.10.010
Sevinc, F., Turgut, K., Sevinc, M., Derinbay Ekici, O., Coskun, A., Koc, Y., et al. (2007). Eficacia terapéutica y profiláctica del dipropionato de imidocarb en la infección experimental por Babesia ovis de corderos. Veterinario Parasitol. 149, 65–71. doi: 10.1016/j.vetpar.2007.07.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sevinc, F., Zhou, M., Cao, S., Ceylan, O., Aydin, M. F., Sevinc, M., et al. (2018). Agentes hemoparásitos asociados a la babesiosis ovina: una posible interacción negativa entre Babesia ovis y Theileria ovis. Veterinario Parasitol. 252, 143–147. doi: 10.1016/j.vetpar.2018.02.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Stevanovic, O., Radalj, A., Subic, I., Jovanovic, N. M., Sladojevic, Z., Amovic, M., et al. (2022). La presencia de babesiosis ovina maligna en Bosnia y Herzegovina indica un posible riesgo emergente para la región de los Balcanes. Comp. Immunol. Microbiol. Infecta. Dis. 90-91, 101893. doi: 10.1016/j.cimid.2022.101893
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Terkawi, M. A., Jia, H., Gabriel, A., Goo, Y. K., Nishikawa, Y., Yokoyama, N., et al. (2007). Un antígeno compartido entre especies de Babesia: fosfoproteína ribosómica P0 como candidata universal a vacuna babesial. Parasitol. Res. 102, 35–40. DOI: 10.1007/S00436-007-0718-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Thekkiniath, J., Mootien, S., Lawres, L., Perrin, B. A., Gewirtz, M., Krause, P. J., et al. (2018). BmGPAC, un ensayo de captura de antígeno para la detección de la infección activa por Babesia microti. J. Clin. Microbiol. 56, E00067–E00018. doi: 10.1128/JCM.00067-18
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Uilenberg, G. (2006). Babesia-una visión histórica. Veterinario Parasitol. 138, 3–10. doi: 10.1016/j.vetpar.2006.01.035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ulucesme, M. C., Ozubek, S., Karoglu, A., Turk, Z. I., Olmus, I., Irehan, B., et al. (2023). Piroplasmosis de pequeños rumiantes: Alta prevalencia de Babesia aktasi n. sp. en cabras de Türkiye. Patógenos 12, 514. doi: 10.3390/patógenos12040514
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yeruham, I., Hadani, A., Galker, F., Avidar, Y., Bogin, E. (1998). Estudios clínicos, clinopatológicos y serológicos de Babesia ovis en ovejas infectadas experimentalmente. Zentralbl Veterinarmed B. 45, 385–394. doi: 10.1111/j.1439-0450.1998.tb00807.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Yin, H., Lu, W. S., Luo, J. X. (1997). Babesiosis en China. Trop. Anim. Salud Prod. 29, 11S–15S. doi: 10.1007/BF02632908
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: BoSA1, reacción cruzada, diagnóstico, parasitemia, ELISA sándwich
Cita: Sevinc F, Zhou M, Cao S, Ceylan O, Ulucesme MC, Ozubek S, Aktas M y Xuan X (2023) Babesia ovis secretó antígeno-1 es un marcador diagnóstico durante las infecciones activas por Babesia ovis en ovejas. Frente. Celda. Infecta. Microbiol. 13:1238369. doi: 10.3389/fcimb.2023.1238369
Recibido: 11 de junio de 2023; Aprobado: 24 de julio de 2023;
Publicado: 16 agosto 2023.
Editado por:
Chaoqun Yao, Ross University, Estados Unidos
Revisado por:
Shahin Tajeri, Universidad Libre de Berlín, Alemania
Benjamin Cull, Universidad de Minnesota Twin Cities, Estados Unidos
Derechos de autor © 2023 Sevinc, Zhou, Cao, Ceylan, Ulucesme, Ozubek, Aktas y Xuan. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Ferda Sevinc, fsevic@selcuk.edu.tr; Shinuo Cao, shinuo_cao@163.com
†Estos autores han contribuido igualmente a este trabajo.
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

