La Babesiosis bovina es también llamada Piroplasmosis; Fiebre de Texas; Aguas rojas.
La babesiosis bovina es una enfermedad febril transmitida por garrapatas y causada por uno o más parásitos protozoarios del género Babesia que generalmente se caracteriza por una lisis eritrocítica extensiva que conduce a anemia, ictericia, hemoglobinuria y muerte.
Existen por lo menos seis especies de Babesia descritas, que son responsables de la babesiosis bovina; todas pueden, ser agrupadas por su tamaño, como grandes o pequeñas.
Tanto la diferenciación morfológica como la serológica son las que determinan la identificación de varias babesias. Las dos más conocidas o de mayor interés en Nortemérica son: Babesia bigemina y Babesia bovis, transmitidas primariamente por las garrapatas el género Boophilus.
Estas especies y sus garrapatas vectoras una vez estuvieron presentes en grandes zonas de los EE.UU. y aun están presentes en México y en la mayoría de las zonas tropicales y subtropicales del hemisferio occidental.
Babesia bigemina
Es grande y pleomórfica; característicamente se observa y se identifica por un par de corpúsculos en forma de pera unidos en ángulo agudo dentro del eritrocito maduro. También hay formas redondas que miden entre 2 y 3 micras y aquellas en forma de pera o alargadas, que miden entre 4 y 5 micras.
Signos clínicos
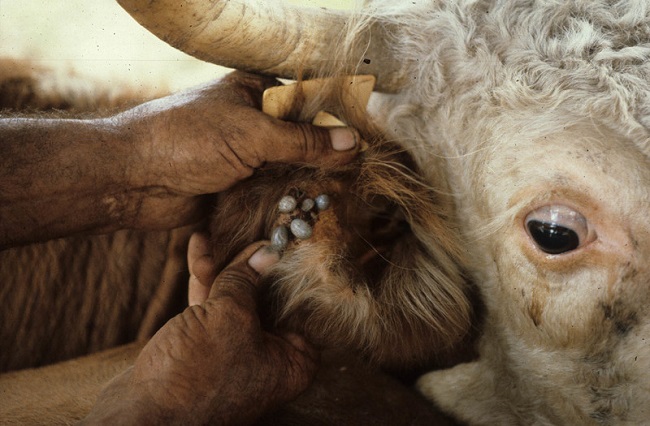
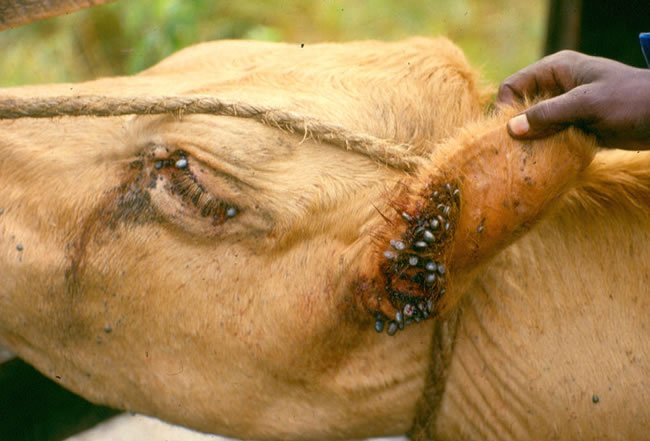
La infección con B. bigemina generalmente está acompañada por la presencia de las garrapatas Boophilus. La transmisión natural es por la alimentación de ninfas y garrapatas adultas infectadas, y la infección se manifiesta entre 2 y 3 semanas después de la infestación.
Después de la inoculación con sangre infectada, el período de incubación puede ser entre 3 y 4 días, o menos, dependiendo del volumen del inóculo de exposición.
Normalmente los terneros son bastante resistentes a la Babesia y la infección, por lo general, no produce enfermedad clínica.
En animales más viejos, los signos clínicos pueden ser muy severos, sin embargo, las diferencias en patogenicidad se asocian con diferentes zonas geográficas, aun cuando el aislamiento sea de B. bigemina.
Generalmente el primer signo es fiebre alta con temperaturas rectales que llegan hasta los 41.5 °C. Hay anorexia y atonía del rumen. La primera observación de la infección con frecuencia es el aislamiento del animal afectado del resto del hato; se observa inquieto, buscando sombra e, incluso, puede echarse.
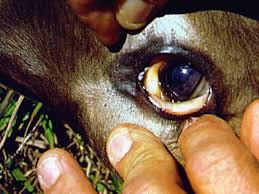
El bovino puede estar parado con el lomo arqueado, tener el pelo grueso o hirsuto y mostrar evidencia de disnea y taquicardia; las membranas mucosas se ven inyectadas y enrojecidas primero, pero conforme la lisis eritrocítica progresa, el color se va tornando a pálido debido a la anemia.
La anemia es un factor que contribuye a la debilidad y a la pérdida de la condición observada en el ganado sobreviviente a la fase aguda de la enfermedad. La anemia puede presentarse en pocos días con la destrucción de 75% o más de los eritrocitos.
Esto, generalmente está asociado con hemoglobinemia y hemoglobinuria severas.
Después del inicio de la fiebre, la crisis generalmente termina una semana después y si el animal sobrevive, comúnmente hay una severa pérdida de peso, baja de la producción láctea, aborto y una recuperación prolongada. La mortalidad es extremadamente variable y puede llegar a 50% o más, pero en la ausencia de un estrés marcado, la mayoría de los animales sobreviven.
Lesiones macroscópicas
En el ganado que muere en la fase inicial de la infección, los pulmones pueden estar edematosos y congestionados. El saco pericárdico puede contener líquido serosanguíneo y hemorragias subepicárdicas y subendocárdicas de tipo petequial.
El hígado se encuentra aumentado de tamaño e ictérico, y la vesícula biliar puede mostrar hemorragias en la superficie mucosa y estar distendida con bilis gruesa y de color verde oscuro; el bazo está marcadamente aumentado con consistencia pulposa y obscura.
El abomaso y la mucosa intestinal se pueden observar ictéricos y, en algunas partes, con hemorragias subserosas. La sangre está delgada y acuosa.
La vejiga urinaria frecuentemente está distendida, la orina oscura de color rojo café; la ictericia comúnmente está distribuida en el tejido conectivo; los ganglios linfáticos están edematosos y pueden presentar petequias.
En el ganado que ha sufrido un proceso más prolongado, las lesiones agudas son menos evidentes. Se pueden encontrar hemorragias petequiales subepicárdicas; el cadáver generalmente está emaciado e ictérico y la sangre es delgada y acuosa, las fascias intermusculares están edematosas, el hígado de color café, y la bilis puede contener escamas de material semisólido.
Los riñones se ven pálidos, con frecuencia edematosos y la vejiga puede contener orina normal, dependiendo de cuánto ha pasado desde la crisis hemolítica hasta la realización de la necropsia. Aun cuando el bazo se ve aumentado, la pulpa es más firme que en la babesiosis aguda.
Diagnóstico de campo
Fiebre, anemia, ictericia y hemoglobinuria, son signos clínicos sugestivos de babesiosis en el bovino localizado en zonas enzoóticas de garrapatas Boophilus.
Si estos signos están también ligados a esplenomegalia y a lesiones post mortem asociadas con destrucción eritrocítica, el diagnóstico de babesiosis se refuerza.
El diagnóstico positivo requiere la identificación de la Babesia en los frotis sanguíneos o pruebas serológicas positivas y/o experimentos de transmisión.
Diagnóstico de laboratorio
La infección aguda con Babesia bigemina generalmente se detecta en los frotis sanguíneos delgados teñidos con Giemsa.
Los frotis gruesos aumentan la posibilidad de detectar al organismo causal, pero la morfología característica es más difícil de identificar con esta técnica. En los casos de infección crónica, el diagnóstico generalmente se hace utilizando varias pruebas serológicas para la detección de anticuerpos específicos, ya que el organismo causal desaparece o esta presente en un número extremadamente bajo, después de la infección aguda.
Diagnóstico diferencial
La anaplasmosis, la tripanosomiasis, la teileriasis, la leptospirosis bovina, la hemoglobinuria bacilar, la hemobartonelosis y la eperitrozoonosis, son enfermedades que deben ser consideradas en el diagnóstico diferencial, por su parecido con la babesiosis.
Pronóstico
Después del inicio de la hemoglobinuria, el pronóstico es pobre. Entre los animales viejos completamente susceptibles la mortalidad puede llegar a 50% si no se da tratamiento. Entre los bovinos que se crían en zonas de babesiosis endémica, las pérdidas son pocas, aun cuando exista la infección.
Esto generalmente refleja una exposición temprana del neonato, cuando de forma natural son más resistentes y, probablemente, reciben anticuerpos calostrales que brindan protección transitoria variable.
Después de sufrir la infección, el bovino tiene un alto grado de resistencia a la reexposición.
Distribución geográfica
La B. bigemina está ampliamente diseminada en el ganado y ocurre en cualquier lugar en el que se encuentren las garrapatas del género Boophilus, se incluye el norte y el sur de América, Europa, África, Asia y Australia. La babesiosis también se presenta en el Caribe y en las islas del Pacífico sur.
El bovino y los hospederos invertebrados (la garrapata) constituyen el mayor reservorio de la infección. La fauna silvestre y los hospederos no bovinos no han sido incriminados.
Transmisión
Las garrapatas adquieren la infección por Babesia durante su alimentación en animales infectados. La infección entonces pasa a los ovarios y las larvas que están emergiendo son portadoras de la infección.
La Babesia continúa desarrollándose dentro de las larvas y generalmente se transmite a un nuevo hospedero durante las fases de ninfa y adulta. Las garrapatas Boophilus, Rhipicephalus, Ixodes y Haemaphysalis son los principales vectores de la Babesia bigemina.
La transmisión mecánica es posible, pero generalmente de este modo no es suficiente para mantener la infección si no existen los vectores específicos o garrapatas.
Huéspedes
El bovino es el principal hospedero, pero se ha reportado que el búfalo de agua y el búfalo africano también pueden infectarse.
Medidas preventivas
El procedimiento más viejo y probablemente más efectivo para el control de la babesiosis es erradicar a su vector, la garrapata Boophilus. La campaña de erradicación en los EE.UU. llevada a cabo en las décadas de los años 20 y 30, dependió básicamente de sumergir al ganado cada 2 o 3 semanas en baños cargados con acaricidas arsenicales.
Estos acaricidas han sido reemplazados por una gran variedad de compuestos mejorados, incluyendo los hidrocarburos clorados, los organofosforados, las piretrinas naturales y sintéticas.
En algunos países tropicales, la meta es el control de la garrapata, más que la erradicación. Con este sistema se intenta obtener una situación estable, en la cual el número de garrapatas sea suficiente para mantener un nivel bajo de infección en el ganado y, por lo tanto, inmunidad a la babesiosis aguda, pero con el número de garrapatas por debajo de aquel que induciría pérdidas primarias por la babesiosis.
En ausencia de la reinfección, la Babesia gradualmente desaparece pero el ganado se vuelve susceptible, por ello el deseo de tener bajos niveles de exposición y mantener una infección inmunizante. En algunas zonas, el control de las garrapatas ha sido complicado por el desarrollo de resistencia en las garrapatas contra muchos de los acaricidas comunes.
Tratamiento
El tratamiento exitoso contra la B. bigemina depende de un diagnóstico temprano y de la administración rápida de medicamentos efectivos. Hay menos posibilidad de éxito si el tratamiento es retrasado hasta que el animal se ha debilitado por fiebre y anemia. Sin embargo, si se administran los medicamentos a tiempo, el éxito es seguro ya que existe un gran número de compuestos efectivos.
Limpieza y desinfección
Además del control y eliminación de las garrapatas vectoras, en zonas enzoóticas la limpieza y la desinfección no son suficientes para el abatimiento en la incidencia de la enfermedad.
Como la mayoría de las enfermedades sanguíneas, se debe tener cuidado en las rutinas de cirugía (descornado, castración, etcétera) y en los procedimientos de vacunación, para prevenir la transferencia accidental de sangre de un animal a otro y así transmitir la infección.
Inmunización
La forma más común de inmunización contra de la B. bigemina consiste en la inoculación de microorganismos vivos (atenuados o virulentos) en ganado susceptible joven, seguido de una quimioterapia adecuada para modificar los efectos clínicos, por lo tanto, se induce una inmunidad coinfecciosa o un estado de premunición.
Babesia bovis.
Es pequeña y pleomórfica, está típicamente identificada como un sólo corpúsculo, como pequeños corpúsculos redondos o como corpúsculos en pares en forma de pera unidos en ángulo obtuso dentro de un eritrocito maduro.
Las formas redondas miden de 1 a 1.5 micras y las de forma de pera de 1.5 a 2.4 micras.
Signos clínicos
Las infecciones de B. bovis se asemejan en muchos aspectos a aquellas observadas en las de B. bigemina, pero existen algunas diferencias características:
La hemoglobinuria y la hemoglobinemia no se observan con frecuencia en las infecciones por B. bovis, aunque pueden presentarse.
El nivel de anemia frecuentemente es menos severo, pero con mayor frecuencia se ve involucrado el sistema nervioso central. Generalmente se acepta que la B. bovis es la más virulenta de ambos organismos; esto es cierto en Australia, pero lo es menos en África y en el hemisferio occidental.
Comúnmente los animales desarrollan incoordinación y depresión postrándose con la cabeza extendida que más tarde echan hacia atrás, con movimientos involuntarios de las piernas durante la postración lateral; después sigue la muerte.
Incubación
La B. bovis tiene un período de incubación más prolongado que el de B. bigemina.
Lesiones post mortem
Los cambios aparentes, son similares a los descritos para B. bigemina. Los capilares de la materia gris, del cerebro y del cerebelo están distendidos con eritrocitos infectados. Generalmente no hay evidencia de una degeneración neuronal o de hemorragia.
Sin embargo, hay dilatación de los espacios perivasculares y edema intersticial.
Diagnóstico
Además de los métodos discutidos para B. bigemina, se ha descrito una técnica de biopsia de cerebro que ha probado ser muy útil para detectar y diagnosticar las infecciones por B. bovis.
La característica de baja parasitemia en la sangre circulante hace a esta técnica muy útil para mejorar las posibilidades de observar al organismo causal. Hay una marcada concentración de eritrocitos infectados en los capilares del cerebro. Las técnicas serológicas de diagnóstico son similares a las descritas para B. bigemina. Actualmente, la prueba de inmunofluorescencia indirecta es la prueba de elección para el diagnóstico serológico de B. bovis.
Diagnóstico diferencial
Además de las condiciones mencionadas para B. bigemina, los efectos cerebrales o del sistema nervioso central que son comunes para B. bovis, pueden ser confundidos con rabia y otras encefalitis.
Pronóstico
Una vez que los signos del sistema nervioso central se establecen, el pronóstico es pobre. Generalmente, B. bovis produce una respuesta clínica mucho más severa que la de B. bigemina.
Distribución geográfica
La B. bovis se presenta generalmente en las mismas zonas que la B. bigemina y en asociación con garrapatas Boophilus, sin embargo, ha sido descrita en algunas partes de Europa, en donde la garrapata Boophilus no existe, lo cual sugiere otros posibles vectores.
Transmisión y hospederos
Las mismas garrapatas (B. annulatus, B. microplus) que transmiten la B. bigemina, generalmente son capaces de transmitir a la B. bovis.
Medidas preventivas: Igual que con B. bigemina la erradicación de la garrapata Boophilus, que es su vector, puede eliminar la transmisión de B. Bovis y después de un período de tiempo la infección desaparece por sí misma.
Tratamiento
Generalmente, la quimioterapia es efectiva, utilizando esencialmente los mismos medicamentos que para la B. bigemina. La B. bovis es un poco más difícil de tratar y es deseable un segundo tratamiento o un ligero aumento en la dosis.



 Videoconferencias5 años atrás
Videoconferencias5 años atrás
 Noticias Internacionales4 años atrás
Noticias Internacionales4 años atrás
 Videoconferencias5 años atrás
Videoconferencias5 años atrás
 Artículos5 años atrás
Artículos5 años atrás
 Noticias Nacionales5 años atrás
Noticias Nacionales5 años atrás
 Charlas Anteriores5 años atrás
Charlas Anteriores5 años atrás
 Noticias Internacionales3 años atrás
Noticias Internacionales3 años atrás
 Cursos A Distancia5 años atrás
Cursos A Distancia5 años atrás